Química del agua en acuario marinos

Mucho se ha hablado de la química del agua, muchas veces acertadamente y otras no tanto, seguramente los conceptos que se mencionan habitualmente son muy apropiados, pero posiblemente el aficionado se le pueden escapar un sin fin de denominaciones y conceptos.
Por esta razón ponemos en marcha este grupo de artículos en los que intentaremos dejar claros los conceptos y sobre todo las denominaciones, con el fin de que cuando hablemos de ellas podamos saber de que hablamos.
En este primer artículo del grupo, nos encargaremos de los átomos espero que os queden claros su composición así como su interacción básica.
Los Átomos
Fueron los filósofos griegos (Leucipo y Demócrito), los primeros que pensaron que todo estaba compuesto por partículas indivisibles a las que llamaron átomos, pero no fue hasta a principios del siglo XIX que los científicos aceptaron esa idea, sin embargo, a principios del siglo XX se descubrió que los átomos estaban compuestos por tres clases de partículas, que son:
Protón, con carga igual, pero de sentido contrario a la del electrón, es decir con carga positiva y una masa unas 2.000 veces mayor que la del electrón.
Neutrón, sin carga (o carga neutra que es lo mismo) con la misma masa que el protón, es decir unas 2.000 veces mayor que la del electrón.
Por tanto, los diferentes elementos que existen en la tierra (118), están formados por sólo tres clases de partículas, muchísimo más pequeñas que el átomo:
Los elementos
Un elemento es una sustancia pura, lo que significa que por más que se le divida, incluso en partículas infinitesimales, las mismas mantendrán siempre las mismas propiedades, por ejemplo si cogen oro y lo dividen muchas veces incluso en partículas microscópicas, éstas seguirán teniendo las mismas propiedades del oro (color, conductividad, maleabilidad, etc.), sin embargo el agua no es un elemento, es un compuesto, porque las moléculas de agua H2O (dos átomos de hidrógeno y uno de oxígeno), pueden dividirse por electrolisis del agua, y las propiedades de los productos de esa división (hidrógeno y oxígeno) son completamente distintas a las del agua, como ocurre también con la sal (cloruro sódico) que por electrolisis se puede separar en Cloro un gas tóxico y sodio un metal, cuyas propiedades son completamente distintas a las del cloruro sódico, que es la sal común.
El elemento más sencillo, y más abundante en el Universo, formando casi el 90% del mismo, es el Hidrógeno, que se escribe en las fórmulas por su símbolo químico, que generalmente es la primera o dos primeras letras de su nombre, que en este caso es H.
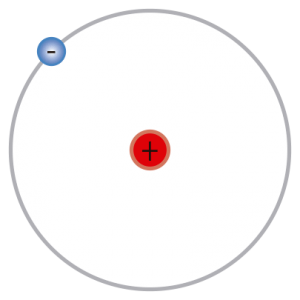
El electrón no cae sobre el núcleo (ya saben que las cargas positivas atraen a las negativas), porque tiene energía que le permite girar y no caer atraído por el núcleo, (y porque no pierde energía por radiación cuando está en su nivel de energía de acuerdo a la mecánica cuántica), de la misma forma que la luna no cae sobre la tierra atraída por la fuerza de gravedad de ésta porque tiene energía, de la misma forma que la tierra y los restantes planetas, no caen sobre el sol, a pesar de gran la fuerza de atracción de gravedad que tiene éste, por la gran energía que tienen. Aquellos planetas que están más lejos tienen más energía, como los electrones que están más lejos del núcleo del átomo.
(Nota: Esta es una explicación sencilla y suficiente para que entiendan como se forman las moléculas y el funcionamiento de los filtros Hydra. Si hay personas versadas en química, encontrarán una explicación más completa en el siguiente enlace:
Los protones
Los protones se repelen fuertemente pues tienen la misma carga positiva, y ya saben que las partículas con cargas opuestas se atraen, y las que tienen cargas iguales se repelen. Para paliar la repulsión de los protones en el átomo de helio hay dos neutrones, el átomo de hidrógeno es el único que no tiene neutrones, pues no son necesarios pues sólo tiene un protón en el núcleo y por tanto no sufre la fuerza de repulsión de otro protón de carga positiva, y no necesita neutrones para mitigar esa fuerte repulsión entre los protones.
Es importante recuerden que los átomos de los elementos tienen una carga neutra, o lo que es lo mismo no tienen carga ni negativa ni positiva, porque, aunque el electrón tiene una masa 2.000 veces menor que el protón, tiene la misma carga eléctrica, pero de signo contrario a la de los protones, los neutrones como su nombre indica son neutros, y por tanto no tienen carga ni positiva ni negativa.
El helio (en griego sol), tiene una composición muy estable al tener dos electrones, y pertenece a un grupo de elementos conocidos como gases nobles o inertes, porque no reaccionan con nada, ni siquiera entre ellos mismos, entre los mismos está el argón Ar que forma parte del aire, el neón Ne, el criptón Kr (como anécdota recordarán que la “kriptonita” debilitaba a Superman) el Xenón Xe y el radón Rn.
Todos los gases nobles comparten la misma característica, ya que todos ellos – con la excepción del Helio – tienen en su capa de electrones más externa, que se llama capa de valencia, ocho electrones, que es una configuración que los hace muy estables, por lo que no reaccionan con otros átomos, ni siquiera con ellos mismos.
Los restantes átomos tienden – como las personas que desean un empleo fijo y seguro – a tener también una configuración estable, lo que se logra teniendo 8 electrones en su capa más externa, y a ello se llama “la regla del octeto”, y para ello reaccionan entre sí, o con otros elementos, para compartir los electrones de las capas externas de cada átomo, formando así moléculas, en las que cada uno de los átomos de las mismas, tenga ocho electrones – con la excepción del hidrógeno que busca tener dos electrones como el gas noble Helio, al que anteriormente nos hemos referido.
El agua
Para los acuaristas es necesario conocer una serie de conceptos de química, que les ayuden a comprender una serie de sustancias o parámetros, de gran importancia para la salud de los peces, tales como el muy tóxico amoniaco, cuya fórmula es NH3 (1 átomo de Nitrógeno N y 3 de Hidrógeno), el ion amonio NH4+, que a pesar de tener una fórmula y un nombre muy parecido al amoniaco, no es tóxico para los peces, el pH que es un índice de la mayor o menor acidez del agua, los nitritos, los nitratos, y algunas sustancias más a las que nos referiremos posteriormente. Pero para entender el comportamiento de esas sustancias en el acuario, y su influencia en sus peces e invertebrados, es imprescindible que se tenga un buen conocimiento del agua.
El hidrógeno y el oxígeno, no se presentan en la naturaleza, como un solo átomo, sino que se presentan en forma de moléculas diatómicas, H2 y O2, el subíndice 2 significa que es una molécula con dos átomos iguales, y los átomos de oxígeno e hidrógeno, prefieren esa configuración como moléculas diatómicas, porque las mismas son más estables que sus átomos por separado, y además sus electrones necesitan menos energía cuando forman estas moléculas diatómicas que cuando los átomos no se combinan entre sí.
A continuación insertó las imágenes de un átomo de Oxígeno (de símbolo O) que tiene como número atómico 8, lo que significa que tiene 8 protones en el núcleo además de 8 neutrones, y 8 electrones girando en torno al mismo, pero observen un detalle importante, hay dos electrones en la capa más cercana al núcleo, y luego otros seis en una segunda capa, y es que los electrones de los átomos se sitúan en capas con la misma energía, pero además esas capas tienen el mismo número para todos los átomos, la primera y más cercana al núcleo tiene un máximo de dos electrones, que son los que tienen menos energía, la segunda tiene un máximo de ocho electrones todos con la misma energía.
Una vez que se llena la segunda capa con ocho electrones, se tiene que llenar una tercera con 18, también todos con el mismo nivel de energía, y luego una cuarta con 32, la quinta tiene 18 de nuevo, puede haber más capas, pero lo importante es que sepan que todos los electrones de una capa tienen la misma energía, y que los electrones de las capas más alejadas del núcleo del átomo tienen más energía que las más cercanas.
Átomo de Oxígeno
Se dice que los átomos de oxígeno e hidrógeno se unen para formar moléculas de agua, mediante un enlace que se llama covalente, y la unión es muy fuerte, hace falta mucha energía para separar los átomos de hidrógeno y oxígeno de una molécula de agua, como por ejemplo, el de una considerable corriente eléctrica entre dos electrodos sumergidos en agua, los átomos de hidrógeno y oxígeno están enlazados con una fuerza similar al de una cadena que para romperla hace falta mucha fuerza.
Los átomos de hidrógeno y oxígeno se combinan entre sí para formar moléculas de agua, porque así tienen menos energía que separados, es la ley imperante en la naturaleza, la de la mínima energía.
A su vez tienen que visualizar que esos electrones compartidos entre los átomos de oxígeno, tienen energía que les mantiene anclados a la molécula de agua, es la energía del enlace.
En todas las moléculas, en que los átomos se combinan espontáneamente, las moléculas de los compuestos resultante tienen una configuración con menos energía que la de los átomos que la forma, compartiendo electrones, a lo que se llama enlace, y esos enlaces tienen energía para mantener a los electrones en la molécula.
El que dos átomos hidrógeno y uno de oxígeno e, se combinen formando moléculas de agua, para consumir menos energía, obedece a una ley universal, que incluye a todos los seres vivos, y también a la materia muerta y a los átomos que la constituyen, todos buscan la manera de gastar menos energía, por ejemplo si se hace pasar el agua de una piscina por el filtro lleno de arena, si no se hace un contra lavado, la suciedad va acumulándose en la arena del filtro, que acaba siendo una bola compacta, como el agua busca el camino que le signifique un menor gasto de energía, fluye por el exterior de la bola compacta, y como resultado el filtro al no pasar por el material filtrante que es la arena, no filtra. Ustedes mismos si no van a hacer ejercicio, y están en casa, se sentarán, porque consumen menos energía que estando de pie, exactamente eso es lo que les ocurre a los átomos, reaccionan de forma espontánea entre sí para formar moléculas en las que sus electrones gasten menos energía.
Si hay que aportar energía para que se formen esas moléculas, las reacciones para formarlas no se producen de forma espontánea.
Átomo de Hidrógeno
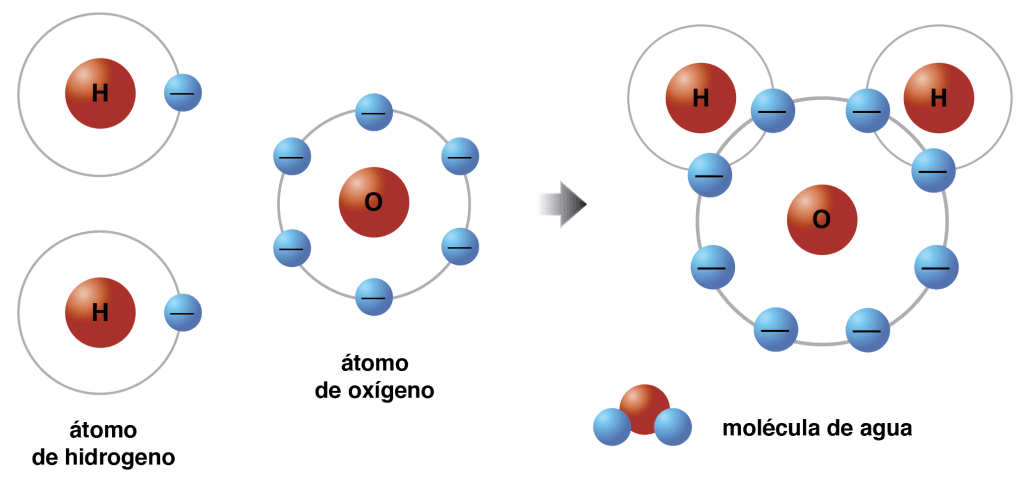
Sin embargo la configuración del hidrógeno con un solo electrón, no es estable, por eso el hidrógeno se combina con otros elementos, o consigo mismo, para tener una configuración más estable, en la que tenga menos energía que si estuviese separado, lo que se logra cuando tiene dos electrones en lugar de uno, el oxígeno tampoco es estable pues tiene 6 electrones en su capa externa, y para ser estable necesita ocho (regla del octeto), así que si se colocan átomos de hidrógeno y oxígeno juntos, llegan a un acuerdo (reaccionan), compartiendo los electrones de la capa externa, para formar una molécula de agua, tal como puede observarse en las imágenes que se insertan a continuación.
En la primera imagen que sigue, pueden ver dos átomos de hidrógeno cada uno con un electrón y uno de oxigeno con seis en su capa externa, al reaccionar y compartir los electrones los átomos de Hidrógeno logran tener dos electrones en su capa externa y el oxígeno ocho, que es la configuración de una molécula de agua.
Esto se puede observar con más claridad en la siguiente imagen de una molécula de agua:
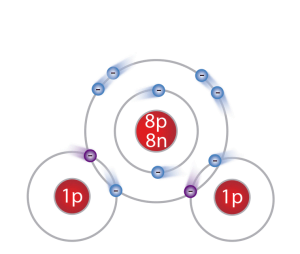
Por supuesto que los electrones son iguales en todos los átomos, pero se han coloreado en rojo los del oxígeno y en azul los del hidrógeno.
La unión de los átomos de oxígeno e hidrógeno
Este dibujo sirve para mostrar cómo se unen los átomos de hidrógeno y oxígeno para formar moléculas de agua, sin embargo la realidad es algo distinta, los electrones compartidos por los átomos de hidrógeno y oxígeno, son más atraídos por el núcleo del átomo de oxigeno con 8 portones con carga positiva, que por los de los dos átomos de hidrógeno, que tienen un solo protón, por eso los electrones con carga negativa se acercan más al núcleo de oxígeno, por ello la molécula de agua tiene el extremo donde se sitúa el oxígeno con carga negativa, y el de los dos átomos de hidrógeno con carga positiva, se dice que la moléculas de agua son polares, porque tienen polos positivos donde se localizan los núcleos del Hidrógeno, y un polo negativo donde se localiza el núcleo del oxígeno, algo muy parecido a lo que ocurre con los imanes con sus polos negativos y positivos.
Las moléculas de agua se unen entre sí, como puede verse en las siguientes figuras, por la atracción de la parte negativa de una (la del átomo de Oxígeno), con las partes positivas de otras (la de los átomos de Hidrógeno), como si fuesen pequeños imanes.
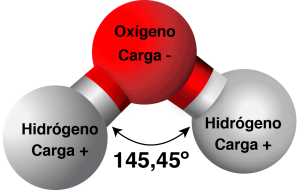
Las moléculas de agua son extremadamente pequeñas, y se mantienen unidas gracias a esa unión entre la parte negativa de unas con las positivas de otras, tanto que en una gota de agua hay aproximadamente mil seiscientos trillones de moléculas de agua. Por eso, aunque es una exageración, se dice que hay tantas moléculas en una gota de agua como estrellas en el Universo.
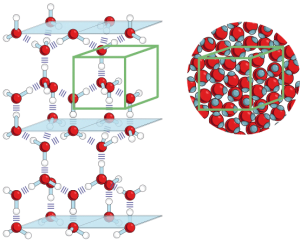
El agua tiene algunas propiedades únicas, como, por ejemplo, que al contrario de lo que pasa con la mayoría de los elementos que son más pesados cuando son líquidos que cuando son sólidos, el hielo es más liviano que el agua y flota sobre la misma, eso posibilita la vida y en los océanos árticos y antárticos, bajo la capa de hielo sigue bullendo la vida.
Como puede verse en la imagen anterior, las moléculas de agua están más separadas cuando forman hielo, y por eso su densidad es menor, que es lo que hace que el hielo flote sobre el agua.
acuariofilia, acuarios, agua, química, química del agua, valores, valores del agua